动物行为与光电专题(42)丨星空体育官网双光子荧光显微镜应用<
发布时间2024-10-01
双光子荧光显微镜(two-photon fluoresce ncemicroscope,TPM)是近年来逐渐兴起的一种新技术,它结合了共聚焦激光扫描显微镜和双光子荧光成像技术。又因其可以对活体动物进行大面积细胞功能活动四维实时监测,具有穿透性强,信噪比小和光对活体组织的损伤小等技术优势,在越来越多的生命科学研究领域扮演着重要角色,得到广泛的应用,包括生理学,神经生物学、胚胎学和组织工程学生物学,极大地促进了作者对复杂大脑皮质系统的结构功能的探索研究,从而在生命科学研究领域取得许多重大突破。但由于显微镜镜头焦距短,仅能够检测活体小鼠大脑浅层的细胞,因此目前利用荧光成像技术主要局限在在体观测实验动物的大脑颅顶皮层神经元。
将小鼠腹腔注射剂量为10mg/kg的戊巴比妥钠,并注射剂量为1mg/kg止痛药丁丙诺啡。当确认达到手术需要的麻醉程度时才可以继续下面实验操作,通过测试小鼠反射来监测评估麻醉深度,必要情况下可少量补。将小鼠放在加热垫上,并使加热垫温度维持在36°C。小鼠的两只眼睛各涂上一滴眼药膏来保护眼睛防止手术灯的强光刺激和干燥。小鼠加头件的方法和很多已经发表过的用双光子显微镜从小鼠颅顶看皮层细胞的方法类似。首先是消毒皮肤。用75%酒精溶液消毒要加头件的颅顶区域,然后用生理盐水沾着棉球擦拭掉酒精溶液,再用无菌手术刀片除去小鼠颅顶毛发,然后用镊子提起头皮用手术剪去除头皮暴露颅骨,然后用棉球沾取少量双氧水轻轻擦拭颅骨以去除表层筋膜,再用手术刀小心的刮去颅骨上粘连的剩余肌肉粘膜组织。值得注意的是用手术刀的力度一定要把握好,避免对颅骨和大脑造成损害。将一个钛合金头件用502胶水先粘到头骨上,用力按压2分钟,待502胶水干透,然后用牙科水泥将周边空隙填满,确保头件粘到牢固,防止后面实验时脱落,至少要等待10分钟待牙科水泥干透才可继续试验。不同于其他文献,在这个实验里,头件只是作为用来将小鼠固定在双光子实验台上的工具,而在其他文献里,加头件不仅是为了固定,更是进行开颅手术以及拍摄双光子的部位。
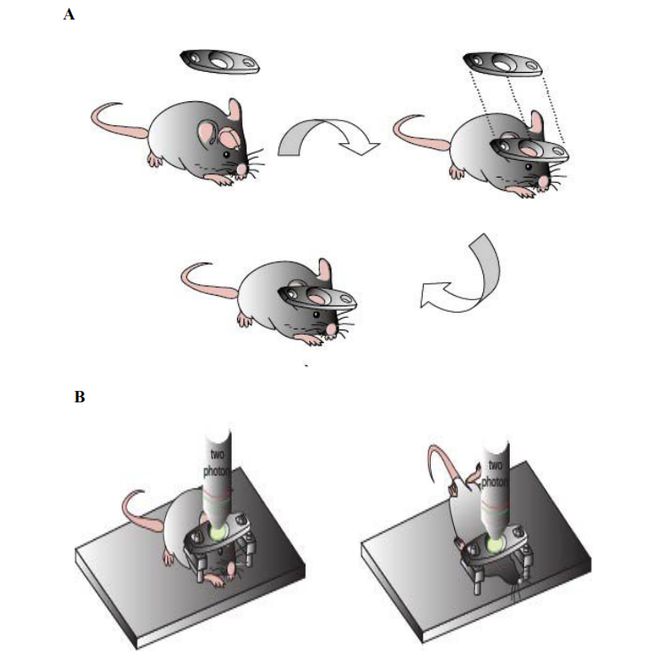
B.小鼠(C57BL/6,6weeks)麻醉后,用502胶水和牙科水泥将一个钛合金头件粘到颅骨上。B.两种双光子镜头拍摄位置对比。左图是目前其他文献中用双光子镜头拍摄的颅顶皮层位置。右图是本篇论文中双光子镜头拍摄的小鼠颅底下丘脑腹内侧核位置。
将即将进行手术的小鼠连上小鼠血氧仪(Mouse Ox pulse oximeter)来实时监测小鼠的生理指标包括体温,血氧饱和度和心率。首先作者将麻醉小鼠摆放成仰卧位,用手术剪剪去除小鼠腿部覆盖的体毛,然后消毒皮肤。用纱布沾上百分之七十五的酒精溶液消毒,再用生理盐水沾着棉球擦拭掉酒精溶液,用纱布沾上碘酒消毒,最后用纱布沾上生理盐水擦拭干净。然后将红外传感器夹在小鼠腿部,再将体温传感器涂抹上凡士林润滑油,插入小鼠直肠监测体温。打开电脑中血氧仪软件,待信号平稳,开始记录。
用手术剪刀去除小鼠脖子处覆盖的毛发,然后消毒皮肤。用纱布沾上百分之七十五的酒精溶液消毒,然后用生理盐水沾着棉球擦拭掉酒精溶液,再用纱布沾上碘酒消毒,最后用纱布沾上生理盐水擦拭干净。在小鼠脖子正中线厘米的切口,暴露下颌腺体,然后用止血钳钝性两边肌肉直到暴露出气管。在气管上用眼科剪剪一个倒T型,然后将特制的3厘米的无菌橡胶管插入小鼠气管。通过很多次实验发现3cm是做颅底暴露手术时气管插管最适合的长度,太长会增加小鼠呼吸阻力;太短,后期实验时,小鼠如果流血或者后面实验时由于双光子镜头是水镜,需要用到人工脑脊液,液体就很容易引流进入橡胶管,堵塞气管,最终使小鼠呼吸终止。所以气管长度的选择对这个实验很重要。最后,用外科手术缝合线给气管插得橡胶管打结。
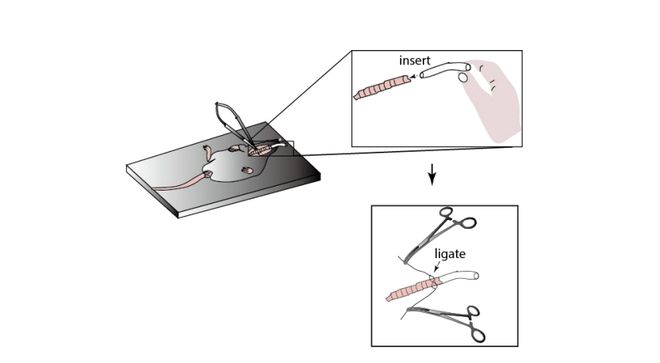
将小鼠置于仰卧姿态,固定在加热垫上。在脖子中线厘米的切口暴露下颌腺体。然后用止血钳钝性分离肌肉直到暴露气管,将一个长约3厘米的橡胶管插入气管并用无菌手术线打结。
将手术电刀的中性电极板粘贴上自制的加热垫,然后将已经被麻醉的小鼠固定在上面。将弯头止血钳尖端紧贴在下颌肌肉上,再将高频电刀尖端垂直放在血管钳尖端,沿红色虚线从上至下缓慢匀速用双极电凝烧灼表面血管。用外科手术剪刀从小鼠两颗门牙中间剪开一道小口,然后继续用高频电刀切开一个更深的口,直到完全分开小鼠的两颗门牙。在这一步,电切模式是首选模式(输出功率是15W),但如果后续实验过程中遇到小鼠血管流血,应该选择使用电凝模式(输出功率是20W)。值得注意的是应避免用手术剪剪开门牙太深,否则容易出血,此位置如果由于手术操作不当造成流血,常常会流血不止并且难以止血,而高频电刀具有凝血功能,所以可以一边切开牙齿,一边凝结表面毛细血管。
用高频电刀沿着红线电切开下颌肌肉。星空官方体育在手术过程中,当遇到血管流血时,应将止血钳贴住流血地方,然后将高频电刀贴近止血钳尖端,按下电凝开关,电流通过止血钳到达流血部位高温止血。用高频电刀电切掉小鼠舌头,注意去舌的速度不宜太快,否则舌根尚未完全凝结,就会出血,又因连着舌头很难止血,最终会导致·小鼠缺血休克而死。但也不宜去舌头速度太慢,因为长时间高温电击小鼠,也容易造成小鼠死亡。在后续的实验中因为越来越靠近要用双光子拍摄的颅底部位,为了尽量减少对小鼠周围组织的伤害和降低深部组织受伤害的风险,需要选择一个相对低功率(输出功率是10W)的持续电流来对小鼠继续手术。用电刀电切小鼠上颚表面,然后就会在颅底中线看到一个很深的骨头腔隙,用小鼠高速颅骨钻把腔隙磨大再把周边的骨头磨薄至半透明状态,用镊子小心地从边缘掀开硬脑膜,去除掉腔隙全部骨头和硬脑膜,这一步一定要细心和耐心,避免出血而危及小鼠生命或者影响成像清晰度。
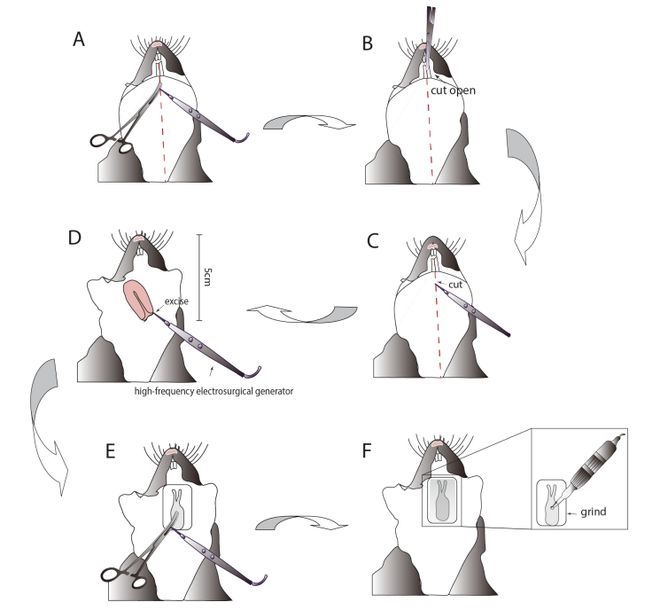
A:将弯头止血钳尖端紧贴在下颌肌肉上,再将高频电刀尖端垂直放在血管钳尖端,沿红色虚线从上至下缓慢匀速用双极电凝烧灼表面血管。B:用外科手术剪将两颗门牙中间剪开一个小口。C:用高频电刀沿着图所示红线电切开下颌肌肉。D:用高频电刀电切掉小鼠舌头。E:用电刀电切小鼠上颚表面。F:用小鼠高速颅骨钻把骨腔隙磨大到约为(2.5mmx5.0mm)的口,再把周边的骨头磨薄至半透明状态,用镊子小心地从边缘掀开硬脑膜,去除掉腔隙骨头和硬脑膜。
用枪头吸5µl的OGB-1注入玻璃微电极,给予重力,使染料到达电极尖端,然后装到微操上。双眼从显微镜里观察电极和小鼠要注入染料部位的位置是否接近,通过微操调节使玻璃电极头以矢状面45º角缓慢地进入要注入染料部位,在快进入之前用注射器给予一正压,然后关闭三通管。当电极到达-550µm的深度时,打开三通管,缓慢推送注射器,注入OGB-1,约0.5µl,然后停留2分钟,再用微操将电极深度向上移到-500µm,注入OGB-1,约0.5µl,然后停留2分钟,再用微操将电极深度向上移到-450µm,注入OGB-1,约0.5µl,然后停留2分钟,就这样一直移到200µm,注入剩余全部OGB-1,关闭三通,停留约10分钟,用微操将玻璃电极上移出小鼠组织。此时,OGB-1染料注射完成。
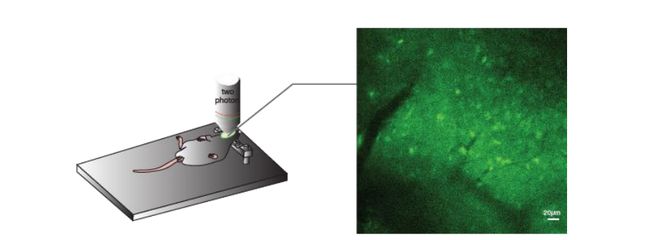
将注射钙离子指示剂OGB-1的麻醉小鼠在双光子显微镜下扫描VMH区域,成像深度约为-300~-550μm,拍摄速度为20.4帧/秒(像素为768x768像素)。
1.王聪. 双光子荧光显微镜用于在体小鼠下丘脑腹内侧核神经细胞内Ca2+检测的方法学探讨[D].安徽医科大学,2018.
往期实验方法,需要的老师可以按照以下操作进行查阅:进入公众号脑声常谈→底部菜单栏脑声助手方法检索→最上方搜索框输入实验名称,您找的实验方法就出来啦!
<