星空中国体育网站【Nature Reviews】二级药理学的最新进展、及新药安全性影响综述<
发布时间2024-08-22
本期分享在国际药物开发创新和质量联盟(IQ)支持下成立了体外二级药理学工作组。对十八家成员公司(赛诺菲,辉瑞,GSK,诺华等)成员如何对二级药理学研究的调研,及对新药安全性的影响,并提出了新的行业二级药理学检测意见。

类药小分子的药理活性超出其预期靶标是药物发现中不可避免的事实。据估计,超过一半已批准的小分子药物与五个以上的蛋白质靶点相互作用,这可能是低估的,因为与大多数药物相比,进行的靶点结合测定数量相对有限。与可成药物基因组中数千个潜在相关的靶标。在某些情况下,由于靶向多种信号通路的好处,多药理学可能有利于药物疗效。例如,阿司匹林的抗炎、镇痛和解热特性,及其对心血管疾病和各种癌症的有益作用,涉及多达 23 个调节多种不同途径的蛋白质靶标。事实上,定向多药理学有时被推广为药物发现的新范例,特别是在肿瘤学中。这些不良反应是由针对其他“脱靶”的特定但非预期的活性引起的,以及脱靶相关的毒性是药物发现过程中失败的主要原因。例如,由于针对人类 KV11.1 (hERG) 的脱靶抑制活性,至少有 9 种不同类别的药物已从市场上撤回或面临标签限制。
制药行业认识到,针对某些次要靶点的药理活性可能会因效益/风险比降低而导致药物失败,这导致小分子药物发现过程中二次药理学筛选测定的增加。靶标是确定超出预期药物靶点的蛋白质相互作用,驱动药理作用,可能对患者造成严重或剂量限制性不良反应。除了对药物发现和开发项目总体成功的影响之外,公司还有责任最大限度地提高安全性,并防止患者或健康的临床试验志愿者因脱靶药理学而面临不必要的并发症风险。
二级药理学评估应用的实践和经验,并根据 Bowes 等人发表以来的几年经验来评估测定小组的有效性和完整性。在国际药物开发创新和质量联盟(IQ)支持下成立了体外二级药理学工作组。十八家成员公司提供了有关筛选实践的详细信息,包括筛选的目标、检测设计和技术、战略方法和结果,例如检测命中率值(专栏1)。
对属于国际药物开发创新与质量联盟行业 DruSafe 领导小组成员的 18 家公司进行了盲法调查,以提供对整个行业常规二级药理学实践的理解。十九家公司对调查做出了回应——艾伯维、安进、阿斯利康、百时美施贵宝、新基(现为百时美施贵宝)、礼来、基因泰克、吉利德科学、葛兰素史克、因塞特、强生、诺华、辉瑞、罗氏、赛诺菲、Sunovion(现住友制药)、武田、UCB Biopharma 和 Vertex。然而,只有 18 家公司提供了适合分析的数据。这 18 家公司包括 14 家大型公司(年收入超过 100 亿美元)和 4 家中型公司(年收入 1-100 亿美元)。
尽管公司之间在检测类型、浓度响应的使用等方面存在方法差异,但大多数接受调查的公司在先导化合物生成和/或先导化合物优化阶段都使用二级药理学分析小分子药物发现。
大多数筛选的靶标(总共 763 个)被确定为野生型人类蛋白目标。尽管这个数字超过了 Santos 等人报道的市售药物靶向的 667 种人类蛋白质。它仅代表约 4,500 个靶点的理论上可成药基因组的一小部分。目前针对所有潜在靶点测试分子在经济上和实践上都不可行,并且科学和经济方面的考虑都适用于在药物发现的每个阶段筛选的靶标组的选择。标准包括预期 AE 的严重性(在预期适应症的背景下)、检测中脱靶活性的预期发生率(检测命中率)、针对特定靶标的检测的可用性和实用性以及预算限制。
对当前进行的检测中的靶标覆盖率进行更深入的检查有助于阐明靶标选择背后的基本原理、新靶标和靶标类别的出现以及其中的潜在差距。图 1显示了靶标的蛋白质类别,说明二级药理学筛选的覆盖范围和多样性。
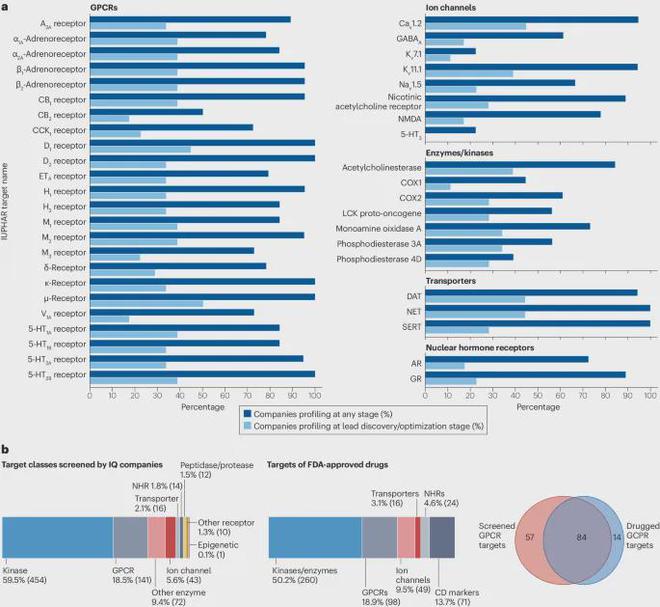
a,Bowes 等人建议的由44个靶标组成的体外二级药理学组的靶标组成,及调查的公司的研究阶段实施情况。b,与 FDA 批准的药物目标类别相比,调查中 18 家公司的二级药理学筛选目标类别覆盖率概览。
在 763 个报告的靶标中,只有 12% 经过三分之一以上的公司筛选。除了这一共识之外,只有一家或几家公司筛选出多种靶点,其中许多蛋白激酶属于这一类别,可能代表这些公司追求的治疗靶点的同一蛋白质家族的亚型。
在各个靶标中,KV11.1 (hERG) 钾通道的测试总数最多 (224,676),该通道由于与心律失常风险相关而一直受到关注。其他经常筛选的靶标包括参与心率调节的毒蕈碱 M2受体(95,329 )、与素 CB1受体(80,051 ),及 µ 阿片受体(78,129 )。IQ 数据库中已有超过 70,000 项测试报告了五种蛋白激酶(TEK、GSK3β、CDK2、AKT 和 Aurora 激酶 B)。这些激酶与炎症和细胞因子产生 (TEK)、神经和心肾功能障碍 (GSK3β)、免疫反应和增殖 (CDK2) 有关、记忆/学习 (AKT) 和遗传毒性和中性粒细胞减少症 (Aurora 激酶 B)。
Bowes 等人提出的 44 个靶标组(Bowes-44 panel)以 G 蛋白偶联受体组(GPCR,24 种蛋白质)为主,但还包括八个离子通道、六种酶、三个转运蛋白、两个核激素受体 (NHR) 和一个原型蛋白激酶, LCK。在接受调查的 18 家公司中,Bowes-44 panel已广泛应用于早期药物研究(图 1)。超过三分之二的受访公司测试了 35 个 Bowes-44 目标,并且至少一半的受访者筛选了 40 个 Bowes-44 目标。如果考虑到不同的靶亚型,共识会进一步增加。例如,一些公司报告筛选 5-HT3和其他 5-HT3A(分别为异五聚体和同五聚体 5-HT3A 离子通道)或磷酸二酯酶的不同异构体。通常,靶标异构体具有非常相似的药理学,并且其他考虑因素会影响要包括的选择。
在前 50 个最常采用的靶标中,只有 3 个不是 Bowes 等人提出的。它们是雌激素受体 ERα、胆囊收缩素 CCK2受体和单胺氧化酶 B。18 家接受调查的公司广泛采用 Bowes-44 组合强调了这一点和随后的出版物强调了靶点与不良事件的关系,推动了药物发现实践的变化,进而导致新型小分子药物的选择性和安全性发生了可测量的变化(专栏2)。
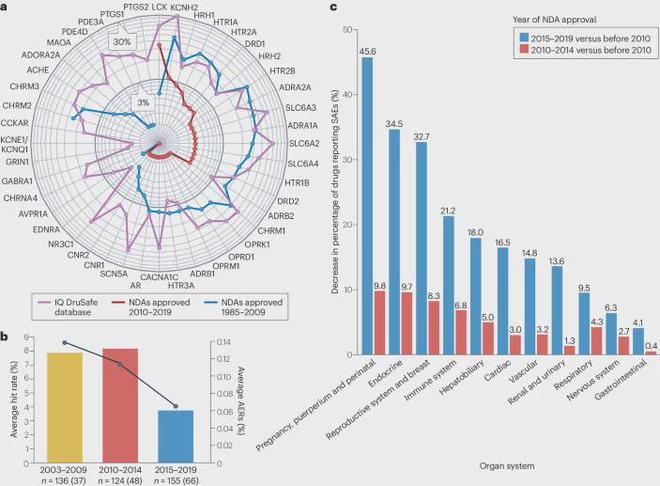
最年上市的小分子药物与十多年前批准的药物相比,脱靶相互作用较少。该图a显示了与 Bowes-44 组(由 Bowes 等人提出的 44 个靶点组成的组)中与安全相关的脱靶相互作用的小分子药物的比例。1985年至2009年期间批准的小分子药物以蓝色显示,最近批准的小分子药物(2010-2019年)以红色显示。IQ DruSafe 数据库(报告为紫色线)的标准化目标命中率作为基准,反映了发现早期阶段的多样化分子库。FDA 的 CDER 数据库中的口服药物按批准年份进行分组,药物脱靶对从 CLARITY 数据库中提取。为了便于阅读,靶标用 IUPHAR(国际基础与临床药理学联盟)基因名称表示。
2010 年之前批准的小分子药物(340 种药物)的命中率与 IQ DruSafe 数据库的公正筛选数据惊人地吻合,平均范围通常在 3% 到 10% 之间,特别是对于大类 G 蛋白偶联受体。对于其他靶标类别,早期药物的混杂性平均低于 IQ DruSafe 样本,除了 KCNH2 (hERG) 等一些高度混杂的靶标外。仅考虑过去十年的小分子药物(183 种药物),数据表明与早期药物或 IQ 数据相比,命中率显著下降。除了 Bowes-44 组中唯一的蛋白激酶 LCK 之外,过去十年中小分子药物的所有命中率均明显低于较旧的小分子药物或 IQ DruSafe 化合物。
过去十年中,与二级药理学命中率下降的同时,不良事件报告 (AER) 也有所下降(图b)。通过 PharmaPendium整理了 FDA 不良事件报告系统中 2003 年至 2019 年批准的新药申请 (NDAs) 的 421 个新分子实体的 AER。
AE 随时间的减少适用于多种靶器官系统(图c)。2010 年至 2014 年期间观察到 AE 频率小幅下降,而 2015 年至 2019 年 AE 发生较大幅度下降,主要表现在内分泌、生殖和妊娠影响方面,但也表现在心脏、血管和肾脏毒性方面。胃肠道和中枢神经系统的不良事件也略有减少。尽管这些趋势的根源可能是多因素的,但药物选择性的增加预计是一个主要因素。
在调查报告的所有靶标中,18% 是 GPCR(141 种蛋白质)。GPCR 是人类膜蛋白最大的超家族,共有 800 多个成员。配体脱靶混杂是由 GPCR 的配体结合腔之间固有的相似性驱动的。GPCR 亚家族通常识别相同或相似的生理配体,从而促进对这种交叉药理学的实验评估。多巴胺能 GPCR 就说明了这一点,它最常用于治疗干预和二次药理学筛选。在 36 种多巴胺能 GPCR 中,97% (35) 与市售药物结合,其中 32 种已在 IQ 数据库中报告。大多数参与公司筛选了 17 个胺能 GPCR 的共识集,包括肾上腺素能、血清素能、毒蕈碱、组胺和多巴胺能受体所有主要类别的代表成员。
其他代表性的靶标类别包括离子通道(58 个靶标)、转运蛋白(16 个靶标)和 NHR(14 个靶标)。在最常测试的离子通道中,三个排名最高的目标是心脏电生理学调节剂(Kv11.1 (hERG)、Cav1.2 和 Nav1.5)。还报道了针对其他心脏和中枢离子通道的许多测试,例如与心率调节和药物滥用相关的烟碱乙酰胆碱受体 α1,以及与神经毒性相关的 NMDA 受体。
调查回复中报告的主要靶标是蛋白激酶。野生型激酶占 763 个总靶标中的 453 个,占报告数据的 50% 以上。这是令人惊讶的,因为激酶在 Bowes-44 组或 Lynch 等人提出的组中并未广泛代表。这一变化可能反映了它们相对较新的出现(过去 20 年)以及作为药物靶标的重要性日益增加。与其他靶标类别相比,筛选组中完整的系统发育激酶组树的覆盖几乎是完整的,提供了并行测试数百种激酶的能力。酪氨酸激酶比其他亚家族被更频繁地测试,这与目前药物中 75% 的蛋白激酶属于此类一致。此外,对激酶筛选调查响应中的测定命中率进行比较表明,酪氨酸激酶的命中率最高。
鉴于作为靶标类别的激酶在标准二级药理学筛选组中的代表性极低,并且针对非激酶蛋白的发现化合物通常不会针对不同的激酶组进行分析,作者研究了这是否可能是当前的关键差距实践。尽管激酶靶向化合物更有可能表现出针对其他激酶的活性,但非激酶靶向化合物针对激酶的化合物混杂率也不容忽视。事实上,10% 的非激酶靶向化合物在 10 µM 浓度下对 src家族酪氨酸激酶 LCK 的抑制率超过 50%(与 Bowes 等人报道的 LCK 命中率一致) ,并且 5% 的非激酶靶向化合物在 10 µM 浓度或低于 10 µM 的半数最大抑制浓度 (IC50) 时对超过 20% 的激酶表现出超过 50% 的抑制作用激酶选择性组合。这些数据表明,当前的筛选实践可能大大低估了这些化合物脱靶激酶活性和相关临床 AE 的潜力。
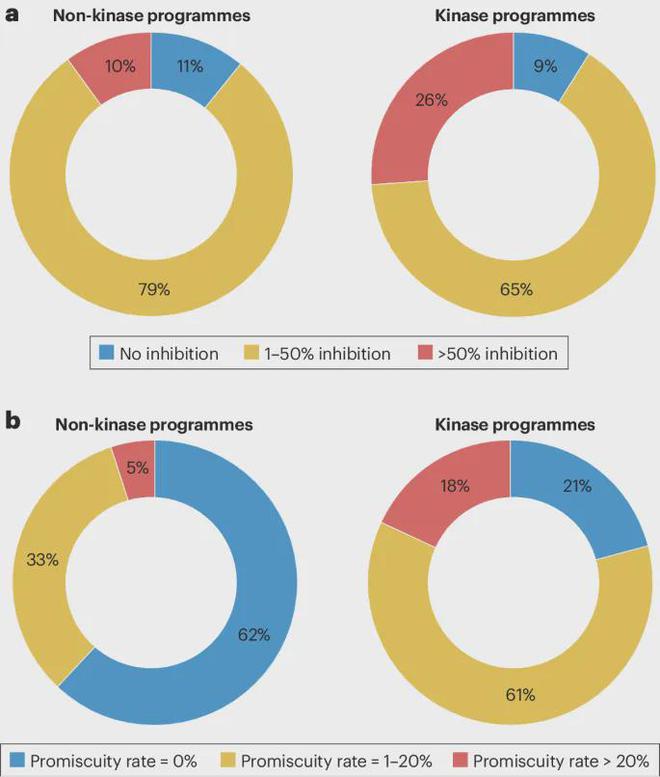
IQ 体外二级药理学工作组的两家成员公司从其内部计划中查询了有关激酶和非激酶计划化合物活性的数据。a, 10 µM 浓度下测定。b,来自非激酶程序和激酶程序 的混杂率化合物的百分比。
重要的 AE 归因于激酶家族的几个成员。由于保守的 ATP 结合位点的相似性,蛋白激酶之间存在高度的交叉药理学,最初阻碍了特定激酶介导的 AE 的定义。随着过去十年精准医疗进入市场,这一限制已基本得到解决。例如,可以根据第一代和新兴的下一代抑制剂推断EGFR特异性作用,所有这些抑制剂都会导致肺和胃肠器官系统中的皮疹和毒性,这些都可以在机制上与 EGFR 在维持上皮屏障完整性中的作用相关联。同样,基于新兴的下一代抑制剂,特定激酶介导的作用可用于KIT(骨髓抑制和毛发脱色)和KDR/VEGFR2(高血压、手足综合征和皮肤脱色)。此外,还建议添加VEGFR1 (FLT1)和 STK35 (CLIK1),因为这两种激酶均已确定存在重大安全风险。
开发和进行二级药理学分析筛选时需要考虑几个关键因素。其中包括研究结果的设计、执行/实施、分析、解释和情境化。在本节中,作者提供有关如何进行此类分析的建议。
Bowes 等人是第一个就二级药理学分析组提供共识意见(尽管仅涉及四家制药公司),其建议已被广泛采用作为最小小组,以了解潜在的脱靶药理学。然而,还有一些具有明确相关责任的目标也应该予以考虑。纳入任何此类靶标必须考虑几个因素,包括明确转化为临床安全责任、命中率以及将目标添加到任何分析小组所需的资源,这可能是令人望而却步的。根据 IQ 调查的分析,提出了一组 33 个靶标供考虑,作为二级药理学分析小组的补充,超出了之前出版物中描述的目标。
在这些新靶标中,有19个是激酶,包括密切相关的家族成员ROCK1和ROCK2,以及AURKA和AURKB。目前尚无数据可最终评估纳入这些类似目标所造成的冗余程度;然而,有一些化合物对 ROCK的一种异构体具有选择性,并且已报道两种异构体对心血管系统有不同的功能作用。下一代激酶抑制剂化合物对单个激酶表现出优异的选择性,并且随着更多关于选择性靶向整个激酶组中特定激酶的化合物(包括在密切相关的蛋白质亚型之间具有选择性的化合物)的安全性的数据产生,激酶组将受到修订和完善。
还有一些其他靶点,它们本身曾被认为是有价值的治疗靶点,但后来发现它们与无法控制或不可接受的 AE 直接相关。其中包括与眼毒性相关的蛋白酶组织蛋白酶D,以及与免疫毒性相关的MALT1副半胱天冬蛋白酶。其他推荐靶点,在某些适应症(例如肿瘤学)中可能是非常成功的治疗靶点,但在其他适应症中存在不可接受的风险,包括ERα。
除了靶标选择之外,一个关键的考虑因素是任何潜在筛选小组的形式,包括是否以单一固定化合物浓度进行测试或测试浓度响应曲线。小组中包含的目标数量通常是对偏离目标责任的总体结果的信心与资源限制之间的平衡。不存在适用于所有情况的单一理想策略,本次调查中的 18 家制药公司明显采用了多种方法。
一种方法是随着研发的进展而在连续更大的组合中进行分析,这种方法提供了多种优势,特别是对于资源可能有限的公司而言。一个较小的多样化早期筛选组合包括 17 个与临床结果有明确联系的靶标,并且从我们对 IQ 数据的分析中显示出相对较高的命中率,可用于快速分析大量化合物。因此,它不仅可以用于有害化合物识别,还可以用于先导化合物优化,作为先导候选物和系列混杂性的早期指标,指导化学反应并影响基于构效关系的优化,以降低可避免的不良事件的风险。
测定模式(结合或功能测定)的选择很重要。对组合中 17 个目标的命中率的分析表明,结合测试往往会高估靶标相对于功能的活性。因此,功能测定将提供更严格的分析,从而减少后续研究。此外,结合测试可能无法检测变构药理学,而这对于离子通道和其他膜靶标尤其重要。例如,测量 GABAA苯二氮卓位点结合的测定可能无法检测正位拮抗剂的活性,因此错过了相关癫痫发作风险的可能性。最后,功能终点可以加深对药理学的理解。根据 IQ 数据库的分析,在感兴趣的靶标中,血清素 5-HT2B受体是结合命中率最高的受体之一 (34.4%)。然而,基于功能测定数据报告的命中率要小得多(功能拮抗剂为 7.7%,功能激动剂为 2.8%)。功能测定中约 68% 的命中是拮抗剂,只有 32% 显示出激动剂活性。因此,单独实施结合测定不仅无法突出该靶点的关注特性(激动作用),而且高命中率还可能导致需要更多资源来更全面地了解风险,或者在最坏的情况下,由于数据的误解,可能会取消选择合适的化合物。
对于考虑进入体内分析的化合物,建议使用更广泛的筛选组合,通过针对已确定的关注靶标定义安全裕度(即,目的靶标半最大有效浓度 (EC50) 或半最大抑制浓度 (IC50) 与峰值血清游离药物浓度 (Cmax) 的比率。这种方法还可以最大限度地减少动物接触次优质量化合物的机会,符合 3R 原则(替代、减少和精炼)。鉴于整个组合的数量较大,建议对初始分析进行单一浓度分析,并针对任何命中进行后续跟踪,生成浓度-响应曲线。正如我们的分析所反映的,一些组织可能会发现,在选择候选药物进入临床试验之前,对化合物进行更全面的分析(例如,使用超过 100 个蛋白的组合)是有益的。
对于激酶靶点,通常在 Km附近的 ATP 底物浓度下评估特定激酶的活性。然而,在确定安全范围时,建议在 1 mM ATP 浓度下进行功能酶测定,代表大多数细胞中的胞质浓度(一般来说,IC50在 1 mM ATP将大于使用 ATP 在 Km浓度下测定的 IC50)。这样可以更适当地估计风险,并考虑到许多与激酶相互作用的化合物在 ATP 位点表现出竞争性结合。
当检测到化合物的脱靶活性时,这并不一定意味着它会产生危险的不良临床效应,并且应该终止其开发。二级药理学数据需要情境化和解释,以建立对风险的清晰理解并避免丢弃可能有前途的药物。通常采用亲和力与最大自由暴露之间 100 倍的一般经验法则来确信候选药物不会达到足够高的水平以对次要目标产生有意义的活性。然而,这可能需要通过使用驱动特定机制的已知药物的数据建立定量转化理解,逐个靶标地进行完善。
尽管我们距离药理学分析中常规探索的许多靶标还远未拥有完整的定量转化数据集,但在过去 5 年中出现的大量报告有助于完善我们的解释。例如,对于Kv11.1 (hERG)钾通道,安全裕度应至少为 30 倍,以确保致心律失常风险较低。对于 5-羟色胺 5-HT2B受体激动剂,在抑制常数 K) 与游离血浆浓度之间 10 倍的范围内,心脏瓣膜病的风险最高,在 10 倍到 70 倍之间的风险为中等倍,且 100 倍时风险较低。需要考虑与感兴趣靶标和给药方案的表达相关的另一个复杂程度。例如,如果靶标在胃肠道中高度表达,口服给药可能会产生更高的局部浓度,因此如果仅考虑血浆浓度,则可能会忽略风险。相反,如果靶标在大脑中表达,当中枢神经系统接触血脑屏障渗透性较差的化合物时,风险可能会降低。
除了安全裕度外,还应考虑与疾病适应症和患者群体相关的风险。疾病状态可以改变生物途径,因此生物和/或病理变化可能会增加在正常健康个体中无法检测到的脱靶相互作用的风险。例如,由于患有哮喘和慢性阻塞性肺病等呼吸系统疾病的患者腺苷水平较高,因此建议通过抑制平衡核苷转运蛋白 1 (SLC29A1) 来加剧严重呼吸困难和支气管痉挛的风险,因为这种抑制可能会加剧严重呼吸困难和支气管痉挛的风险。
风险收益比是进一步考虑的因素。在治疗选择有限的危及生命的疾病的情况下,一些脱靶介导的 AE 可能是可以耐受的,或者在临床上是可以控制的,而对于非危及生命的疾病的长期治疗,AE 的可接受性要低得多,因为风险可能会增加超过了收益。
二级药理学数据通常包含在研究性新药申请中,以定义临床候选药物的选择性概况并评估与已识别的任何脱靶活动相关的风险。这些数据总结在二级药理学研究类别下,主要不需要根据良好实验室规范 (GLP) 要求进行。
监管指导文件中没有精确定义对二级药理学测定及其格式的期望,国际人用药品技术要求协调委员会 (ICH) 指南 S7B 中的 hERG 除外。在这里,根据 IQ 联盟体外二级药理学工作组成员的经验,强调哪些二级药理学数据可能为监管机构提供信息。
Kv11.1 (hERG) 对心脏安全性具有重要意义,因此该次要药理学目标的数据包含在安全药理学研究中。NaV1.5 等离子通道的附加数据已作为最新监管指南的一部分进行整合。本节还提供了全面的心律失常风险分析。GLP Kv11.1 (hERG) 膜片钳数据是安全药理学的监管要求,只有在存在差异时才提供非 GLP Kv11.1 (hERG) 数据测定格式,特别是当发现结合比功能性膜片钳测定数据更有效时。
在其潜在的临床相关性的背景下呈现二级药理学数据是最重要的。这通常是根据最大临床有效游离浓度的功效(IC50或 EC50)倍数来估计的;换句话说,安全裕度以及这种相互作用对健康志愿者和患者的潜在影响。
为了评估次要药理学影响临床终点的可能性,通常使用患者的估计游离 Cmax来确定每个次要药理学将达到的暴露倍数或“安全裕度”地点。每次脱靶的效力高度依赖于所使用的测试系统,激动剂的功效取决于受体表达和信号转导过程。对于某些靶标,例如 Kv11.1 (hERG)、Nav1.5 和 5-HT2B,可能会明确转化为临床结果,但在大多数情况下,所需目标与次要目标之间的效力比大于 100 倍,通常被认为风险较低。对于选择性较低的分子,可能需要额外的测试来评估临床风险。在所有情况下,都应讨论任何潜在不良反应的情况,以确保采取适当的监测和适当的治疗措施。
除了与联盟共享的数据之外,我们还调查了二级药理学在行业中的广泛采用是否产生了可衡量的影响。从我们的数据中无法评估二级药理学是否直接降低了化合物在研发阶段的损耗率,但对2012年以来上市的化合物的分析表明,在接下来的10年中开发的药物明显降低了与其中一个目标相互作用的可能性,以及随之而来的一系列目标器官中总体 AE 发生率的降低(框 2)。
尽管临床前药物发现实践的其他改进,例如更早应用安全性研究、增加计算机评估的部署以及采用更多生理相关的人体体外筛选,无疑有助于近年来药物安全性的改善。药理学混乱与 AE 风险增加之间的关系已得到充分记录,而混乱减少与 AE 发生率降低的巧合表明,二次药理学筛查的广泛采用有助于现实世界中不良事件发生率的改善。确定其他关键靶标-毒性关系并针对这些靶标实施早期反筛选有望进一步减轻新药候选者在非临床和/或临床开发中的副作用负担,提高其效益-风险比和增加他们最终成功的可能性。
本文讨论的二级药理学筛选分析和策略主要集中于识别与小分子药物相关的潜在风险,并消除或至少减少它们。支持将靶标纳入检测组和相关责任的许多信息都源自过去约 50 年的药物项目和临床发现的经验。这反映在 GPCR 在组中占主导地位,反映了 20 世纪末对 GPCR 靶向治疗的关注。最近的科学进展扩大了我们对整个基因组药理学空间的理解,并推动了对新靶标类别和新颖药理学方法的探索。
之前的文章和本文中推荐的靶标组合可以识别并实现许多安全责任的风险评估,但它们不一定提供有关特定类型安全责任的深入机制见解。一种方法是制定具体而全面的目标来解决这些问题。使用最新的可用工具和方法(药理学、遗传和不良事件分析)寻找将生物靶点的活动与不良动物或人类副作用联系起来的信息应继续并得到加强。此外,应鼓励通过更好地了解每个靶标的安全边际来改进数据情境化,以建立与目标无关的风险评估,并为相关的缓解和管理计划提供信息。
2023 年十大制药公司的临床组合(I-III 期)比较表明,全行业约 50% 的小分子项目针对酶、主要是激酶和蛋白酶(图 3)。上面指出了激酶抑制剂在整个激酶组中混杂的倾向,并且在蛋白酶药效团中也有类似的混杂性。由于发现主要靶标类别不一定表示“脱靶”风险类别,次要药理学变得更加复杂。例如,HIV 蛋白酶抑制剂茚地那韦在同类药物中是独一无二的,因为它可以结合并抑制葡萄糖转运蛋白 4 (SLC2A4) 转运蛋白,可能导致胰岛素抵抗。我们还通过调查发现,旨在靶向非激酶蛋白的小分子仍然具有激酶抑制活性的有意义的潜力。因此,建议使用由多种靶标类别(包括激酶)组成的组来分析任何小分子候选药物。
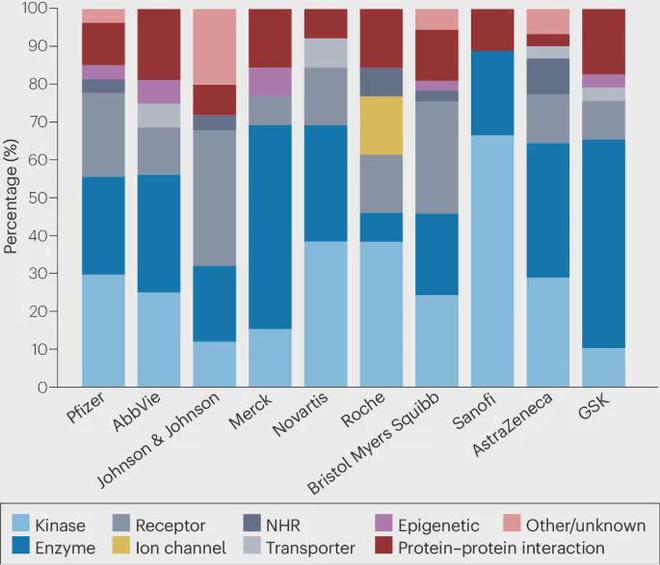
大约 50% 的小分子项目旨在针对酶,主要是激酶和蛋白酶。NHR,核激素受体。
在新药方面,一些新的机制和模式(例如变构调节剂、靶向蛋白质-蛋白质相互作用的药物、抗体-药物缀合物、靶向蛋白质降解剂、肽、基因和细胞疗法、寡核苷酸),以及以前被认为不可成药的靶点(例如表观遗传靶点),现在正变得更加主流。新的模式对当前的二级药理学范式提出了挑战,因为测定形式可能并不总是最佳的,并且在某些情况下对于评估此类药物的脱靶情况是无关的。例如,靶向蛋白质降解剂可能通过诱导非预期靶标的降解而具有脱靶活性。传统的检测形式不会突出降解剂活性。因此,这需要在二级药理学策略中考虑非标准方法,例如蛋白质组学。同样,抗体和基于 RNA 的药物也需要考虑替代方法,例如细胞微阵列技术或生物信息学方法。预计,当我们扩展二级药理学策略以支持新模式时,新平台应经过稳健的方法标准化和验证,以在整个行业中采用一致的方法。确保此类分析采用标准化方法,不仅可以在群体之间提供更多可解释的数据,并确保对脱靶安全责任的最佳检测,而且还有助于将此类数据传达给监管机构。
通过计算机来预测脱靶活动和降低程序风险的计算工具已得到广泛使用,特别是针对 Kv11.1 (hERG)等关键目标,并且它们应该进一步促进更广泛的目标。此外,计算机方法可以结合脱靶分析数据来产生综合预测,其中一些预测被采用到监管框架中(例如,心脏动作电位和致心律失常电位的预测)。
在监管评估和决策中也越来越多地考虑二级药理学数据。二级药理学数据提交流程的改进,例如格式和命名的改变,以及实验设计、实施、分析、解释和报告的标准化,可以增强这些检测方法在监管审查中的效用,包括协助识别安全责任处于开发早期的候选药物。
体外药理学分析还越来越多地应用于其他基于化学的学科(例如农用化学品、环境安全、化妆品、农药和食品添加剂),并在其中显示出价值和影响。化妆品中化学品的下一代风险评估涉及生成广泛的生物活性数据,包括药理学分析数据,以提供生物标志物,然后用于测量消费者相关浓度下成分的生物活性。
特别声明:以上内容(如有图片或视频亦包括在内)为自媒体平台“网易号”用户上传并发布,本平台仅提供信息存储服务。
曝知名美食作家晒与冯唐罗永浩聚餐照,却被骂惨了:竟然和罗永浩同桌,恶心!
70岁原副省级高官苏增添被决定逮捕,曾是福建最年轻的处级干部,被批“搞钱色交易”“退而不休”
OpenAI推出新功能,将允许企业“定制”目前最强大的AI模型GPT-4o
与中坚力量共成长,2024建信信托艺术大奖评委会特别奖获奖艺术家凌海鹏
<